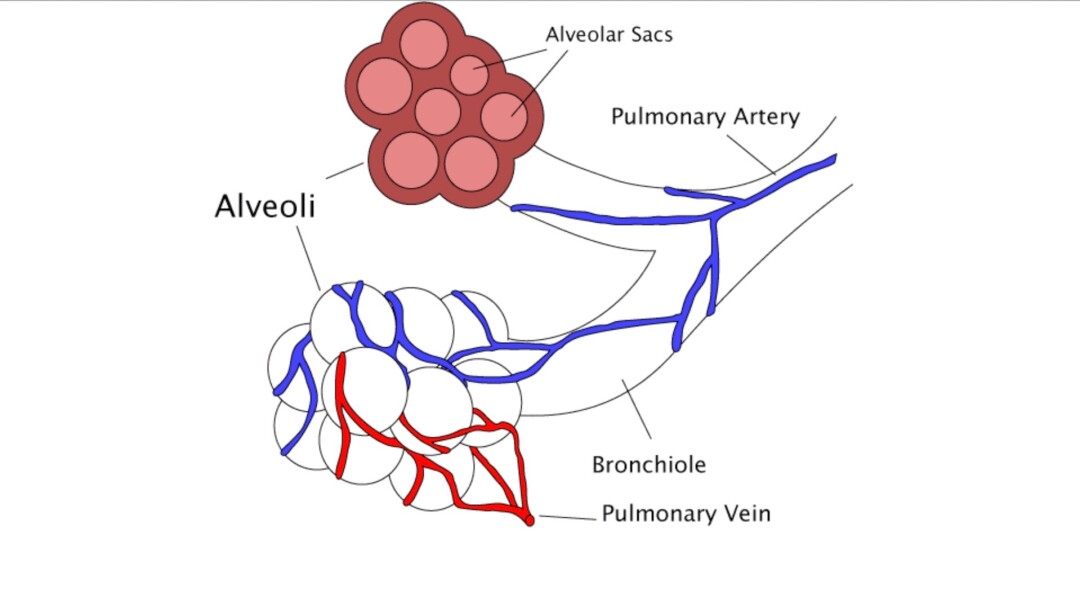
Raffigurazione dei sacchi alveolari e loro rapporti con i bronchioli, le venule e le arteriole polmonari. Immagine CC BY-SA 3.0
Covid-19, Type II Alveolar Cells and Surfactant
Journal of Medical – Clinical Research & Reviews
Covid-19, cellule alveolari di tipo II e surfactant
(articolo tradotto in italiano)
Bracco Lorenzo MD*
Medico Chirurgo, Specialista in Fisiatria,“Diplôme de Université Paris VII” Opzione Clinica in Pathologia Tropicale e Epidemiologia, Psicoterapeuta.
*Corrispondenza:Bracco Lorenzo MD, Lorenzo Bracco Foundation, Corso Marconi 37, 10125 Torino, Italy, Tel: +39 0116688992 Mobile: +39 3331632321 email: lorenzobraccofoundation@gmail.com
Abstract
Nel caso di infezione polmonare da Covid-19 il virus infetta le cellule alveolari di tipo II che di conseguenza riducono la produzione di surfactant polmonare. Il surfactant, termine medico per “tensioattivo”, ha la funzione di ridurre la tensione superficiale degli alveoli. Meno surfactant polmonare c’è, più gli alveoli tendono a collassare per l’aumentata tensione superficiale della loro superficie. Di conseguenza il polmone tenderebbe a collassare, ovvero a ridurre il proprio volume, ma il collasso è impedito dal movimento muscolare dell’inspirazione, che invece ne aumenta il volume. Questo comporta che nello spazio interstiziale si crea una “zona di bassa pressione” che richiama liquido e sostanze che spesso sono infiammatorie e che col tempo si organizzano dando luogo a polmonite interstiziale. La mia proposta è di somministrare al paziente Covid-19 in ventilazione assistita il surfactant polmonare. Questa tecnica è usata abitualmente nei neonati pretermine con carenza di produzione di surfactant polmonare per immaturità delle cellule alveolari di tipo II, in attesa che tali cellule una volta maturate lo producano autonomamente. Analogamente la somministrazione di surfactant durante l’infezione polmonare da Covid-19 permetterebbe di mantenere durante la fase acuta dell’infezione la giusta quantità di surfactant e darebbe il tempo alle cellule di tipo II di guarire e di riprendere autonomamente la produzione di surfactant.
Keywords:Coronavirus, Covid-19, surfactant, tensioattivo, polmone, polmonite interstiziale, cellule alveolari tipo II, ventilazione assistita, ventilatore polmonare, C-PAP, Easy Covid-19, interstizio polmonare, alveolo polmonare, cellule alveolari tipo I, tensione superficiale, clorochinina, azitromicina, tocilizumab.
*******
L’infezione da Coronavirus, Covid-19, diventa problematica per il sistema respiratorio se l’infezione arriva nel polmone. Il Covid-19 ha un tropismo per le cellule epiteliali e per replicarsi nel polmone va a infettare le cellule alveolari di tipo II dell’epitelio alveolare, le quali sono in grado di replicarsi permettendo quindi anche al virus di replicarsi.
L’epitelio alveolare [1] è composto da cellule alveolari di tipo I (le cellule squamose) [2,3], da cellule alveolari di tipo II [4,5] e da macrofagi. Le cellule squamose sono molto sottili e di conseguenza, pur essendo meno numerose delle cellule di tipo II, occupano la maggior parte della superficie dell’alveolo, circa il 95%. Le cellule squamose sono deputate allo scambio respiratorio e non sono in grado di replicarsi. Le cellule alveolari di tipo II sono in grado di replicarsi, dando origine sia alle cellule alveolari di tipo II, sia alle cellule alveolari di tipo I, squamose.
Le cellule di tipo II contengono organelli granulari secretori, chiamati corpi lamellari, fusi con le membrane cellulari. Questi organelli producono il surfactant polmonare [6,7] e lo secernono nello spazio alveolare.
La parola surfactant è acronimo della locuzione: surf(ace) act(ive) a(ge)nte significa “agente superficialmente attivo”, ed è sinonimo, usato in pneumologia, di “tensioattivo”. Il surfactant polmonare è una miscela di lipidi e proteine. La funzione principale del surfactant nell’alveolo è ridurre la tensione superficiale fra l’aria e la superficie umida dell’alveolo stesso.
La tensione superficiale [8] è la tensione meccanica di coesione delle particelle di un liquido sulla sua superficie esterna a contatto con una materia diversa, quale ad esempio l’aria.La tensione superficiale è quella che ad esempio permette alle zanzare di camminare sulla superficie dell’acqua, a una piccola moneta di stare senza affondare sulla superficie dell’acqua posta in un bicchiere (gioco che tutti abbiamo fatto da bambini), a un bicchiere di essere riempito talmente tanto che l’acqua fa come una piccola cupola al di sopra del suo bordo senza straripare. La tensione superficiale fa sì che nell’aria una goccia di liquido, ad esempio di acqua, abbia la minima superficie esterna in rapporto alla sua massa.
I tensioattivi sono sostanze che hanno la proprietà di abbassare la tensione superficiale, ad esempio fra un liquido e l’aria, permettendo il contatto fra i due. Il Covid-19 infettando le cellule alveolari di tipo II interferisce pesantemente con la produzione del surfactant.
Se sull’alveolo polmonare agisse solo la tensione superficiale non contrastata dal surfactant, l’alveolo poco alla volta collasserebbe, perché la tensione superficiale tenderebbe a mantenere la minima superficie esterna alveolare a contatto con l’aria (come capita a una goccia di acqua che ha la minima superficie esterna in rapporto alla sua massa). Quindi gli alveoli più piccoli tenderebbero poco alla volta a collassare e a sparire e di conseguenza tutto il polmone tenderebbe a collassare.
Questa tensione del polmone a collassare contrastata dal movimento inspiratorio che cerca di espandere il polmone, fa sì che ci sia una diminuzione di pressione nell’interstizio. Il tentativo disperato del paziente di usare tutti i muscoli inspiratori, diaframma compreso, per tentare di riempire di aria un polmone che tende per la tensione superficiale degli alveoli a collassare, agisce sull’interstizio polmonare come una pompa aspirante. L’interstizio comincia a riempirsi di liquido e quant’altro che arriva dal circuito sanguigno e che sul lungo tende a mano a mano a strutturarsi in una polmonite interstiziale.
In sintesi, un’infezione di Covid-19 va a infettare proprio le cellule alveolari di tipo II interferendo con la produzione del surfactant. Poco alla volta per mancanza di surfactant con l’aumento della tensione superficiale gli alveoli tendono a collassare riducendo il loro volume. Di conseguenza tutto il polmone tenderebbe a collassare e tenderebbe a diminuire il suo volume. Ma la diminuzione di volume di tutto il polmone non è possibile perché il movimento inspiratorio, cercando di dilatare il polmone, sta facendo esattamente la cosa opposta al collasso, ovvero sta espandendo il volume del polmone. Riducendosi per carenza di surfactant il volume alveolare di un polmone che invece si sta dilatando nell’atto inspiratorio, si crea nell’interstizio, durante l’inspirazione, una diminuzione di pressione. Questa diminuzione di pressione tende a richiamare nell’interstizio liquidi e sostanze che poco alla volta si organizzano dando luogo alla polmonite interstiziale.
Il Covid-19 avendo un tropismo per gli epiteli, ivi compresi quelli vascolari, avrebbe un andamento, secondo alcuni studi, molto simile a quello di alcune malattie autoimmuni, con produzione di analoghe sostanze tossiche. Da qui il vantaggio che ci sarebbe nella somministrazione del tocilizumab, anche conosciuto come atlizumab, un anticorpo monoclonale umanizzato usato soprattutto nel trattamento dell’artrite reumatoide e dell’artrite idiopatica giovanile sistemica.
Il fatto che l’interstizio polmonare durante l’inspirazione si viene a trovare in una situazione che un meteorologo definirebbe di “bassa pressione” è particolarmente pericoloso perché richiamerebbe queste sostanze infiammatorie che verrebbero a infarcire sempre più l’interstizio polmonare. Questa evoluzione verso la polmonite interstiziale può essere peggiorata da patologie concomitanti che nella fase inspiratoria rendono più difficoltoso l’ingresso dell’aria nelle vie respiratorie [9].
Il quadro clinico di grave polmonite interstiziale, dall’inconfondibile immagine radiografica, è un sintomo tardivo del Covid-19 e il paziente in queste condizioni solitamente è intubato, attaccato a un ventilatore polmonare e si trova ricoverato in un reparto di terapia intensiva Covid-19.
Ai primi sintomi di dispnea è terapeuticamente motivato intervenire immediatamente con una ventilazione assistita. Nei casi meno gravi si può fare ricorso a metodi non invasivi, quali ad esempio i caschi C-Pap (Continuous Positive Airway Pressure) [10], che mantengono una aumentata pressione continua di aria arricchita di ossigeno. Molto promettente è l’idea del Dottor Renato Favero di trasformare una maschera per lo snorkeling in dispositivo per ventilazione assistita a pressione continua positiva [11]. Tale maschera permette anche facilmente al paziente di essere posizionato prono. La posizione prona è la posizione più idonea per la respirazione assistita nella polmonite interstiziale come ha dimostrato il Prof. Luciano Gattinoni [12].
Nei casi più gravi è usuale ricorrere a metodi invasivi [13] come intubare e attaccare il paziente al respiratore che insuffla attivamente aria arricchita di ossigeno a ogni atto inspiratorio. Questa pressione, che nel polmone esercita l’aria spinta dal ventilatore polmonare durante l’atto inspiratorio, impedisce ai piccoli alveoli di collassare e nella migliore delle ipotesi tende anche a ridilatarli.
Tuttavia, anche se il paziente usufruisce di respirazione assistita, per l’alta tensione superficiale dell’epitelio alveolare dovuta alla mancanza di surfactant, nella fase inspiratoria vi è una relativa “bassa pressione” a livello dell’interstizio polmonare. Questa relativa “bassa pressione” continua a richiamare nell’interstizio liquidi e sostanze che oltre al resto hanno perlopiù caratteristiche infiammatorie.
Nella ventilazione assistita con paziente intubato la mia proposta è instillare il surfactant, direttamente utilizzando l’intubazione, proprio per evitare questo fenomeno di relativa “bassa pressione” interstiziale. Il surfactant può essere somministrato facilmente nel paziente intubato come si fa nei bambini nati prematuri con sindrome da distress respiratorio [14].
Previa valutazione medica dei rischi e dei benefici, in alcuni casi sarebbe forse opportuna, già ai primi sintomi di dispnea polmonare, la somministrazione di surfactant, ben prima che la dispnea arrivi a livelli tali da rendere necessaria l’intubazione. L’instillazione del surfactant può essere fatta tramite un sondino tracheale, tecnica utilizzata nel neonato con sindrome da distress respiratorio [15]. È possibile ipotizzare che si potrebbero provare negli adulti, affetti da sindrome dispnoica da Covid-19, anche tecniche non invasive di somministrazione del surfactant mediante aerosol. È possibile che la via di somministrazione aerea mediante aerosol nell’adulto, per la maggior collaborazione del paziente, ottenga risultati migliori di quelli ottenuti (come si legge per lo più in letteratura) nei neonati pretermine con sindrome da distress respiratorio [16].
Per riassumere: l’uso del surfactant nel paziente intubato eviterebbe l’arrivo ulteriore, nell’interstizio polmonare, di liquido e di sostanze che molto sovente hanno un carattere infiammatorio. L’uso del surfactant potrebbe impedire agli alveoli di collassare e anzi potrebbe forse farli riespandere e migliorare l’interscambio gassoso a livello polmonare. Inoltre l’uso precoce del surfactant forse limiterebbe anche la necessità di ricorrere all’intubazione.
Nei neonati pretermine, in cui la produzione del surfactant non è sufficiente, l’instillazione di surfactant permette al polmone di funzionare preservandolo il più possibile, in attesa che le cellule alveolari di tipo II arrivino a maturità e producano autonomamente il surfactant. Così l’instillazione di surfactant nell’adulto dispnoico a causa del Covid-19, permetterebbe al polmone di funzionare preservandolo il più possibile e di attraversare il periodo in cui non vi è sufficiente surfactant poiché le cellule alveolari di tipo II, che dovrebbero produrlo, sono infettate. Questo consentirebbe di superare al meglio il periodo della patologia infettiva in atto, attendendo che il virus venga vinto e che nuove cellule alveolari di tipo II producano autonomamente il surfactant necessario.
Poiché la polmonite interstiziale è la manifestazione respiratoria conclamata ed estremamente grave del Covid-19, ha senso contrastare il virus molto prima che questa si verifichi. Ai fini terapeutici è meglio lasciare che la febbre esplichi la sua funzione fisiologica contro il virus, intervenendo con il paracetamolo solo se la febbre diventa tale da essere pericolosa. È parere condiviso da molti l’importanza dell’uso di antivirali immediatamente al primissimo segnale di infezione, quale febbre e/o tosse, senza aspettare che il quadro sintomatologico evolva in polmonite interstiziale. Sicuramente molto valido è l’uso della clorochina nell’infezione da Covid-19, come Didier Raoult e i suoi collaboratori hanno per primi auspicato [17]. La clorochina come antivirale è già stata utilizzata, ad esempio contro il virus HIV. A riprova della validità dei derivati della china, non solo come antimalarico, molti attribuiscono all’introduzione del chinino, arrivato dal Sudamerica e diffusosi in tutto il mondo, una delle cause nell’evo moderno dell’aumentata popolazione mondiale che non era mai andata al di là del mezzo miliardo. Da non dimenticare l’azitromicina [18] che è già in uso abitualmente in pneumologia in polmoniti dall’eziologia incerta.
References
- Hansen, J. E.; Ampaya, E. P.; Bryant, G. H. & Navin, J. J. (1975), The Branching Pattern of Airways and Air Spaces of a Single Human Terminal Bronchiole. Journal of Applied Physiology. 38(6): 983–989. doi: 10.1152/jappl.1975.38.6.983. PMID 1141138.
- Saladin, K (2011), Human anatomy(3rd ed.). McGraw-Hill. pp. 641–643.
- Weinberger, Steven; Cockrill, Barbara; Mandell, Jess (2019), Principles of pulmonary medicine (Seventh ed.). pp. 126–129.
- Ross, Michael H, and Pawlina, Wojciech (2011), Histology, A Text and Atlas, Sixth Edition.
- Fehrenbach H. 2001, Alveolar epithelial type II cell: defender of the alveolus revisited. Respir Res. 2 (1):33–46.
- International Union of Pure and Applied Chemistry IUPAC Gold Book, Surfactant (surface active agent). Last revised: February 24, 2014.
- Edwin J. A. Veldhuizen, Henk P. Haagsman, Role of pulmonary surfactant components in surface film formation and dynamics. Biochimica et Biophysica Acta (BBA) – Biomembranes, Volume 1467, Issue 2, 25 August 2000, Pages 255-270
- Surface Tension (Water Properties) – USGS Water Science School. US Geological Survey. July 2015. Retrieved November 6, 2015.
- Bracco Lorenzo, CORONAVIRUS and PERTUSSIS. Journal of Medical – Clinical Research & Reviews. J Med – Clin Res & Rev. 2020; 4(3); 1-2.
- Patel, BK, Wolfe, KS, Pohlman, AS, Hall, JB, Kress, JP. Effect of noninvasive ventilation delivered by helmet vs face mask on the rate of endotracheal intubation in patients with acute respiratory distress syndrome: A randomized clinical trial. JAMA 2016; 315:2435-41.
- https://www.isinnova.it/easy-covid19/
- Gattinoni, Luciano et al. (2001), Effect of Prone Positioning on the Survival of Patients with Acute Respiratory Failure. The New England Journal of Medicine. August 23, 2001. N Engl J Med 2001; 345:568-573.
- Silvio A. Ñamendys-Silva, Respiratory support for patients with COVID-19 infection. The Lancet. Respiratory Medicine.VOLUME 8, ISSUE 4,PE18,APRIL 01, 2020. Published: March 05, 2020.
- Mallinath Chakraborty, Sailesh Kotecha, Pulmonary Surfactant in Newborn Infants and Children. Breathe 2013 9: 476-488.
- Kiran More, Pankaj Sakhuja, Prakesh S. Shah, Minimally Invasive Surfactant Administration in Preterm Infant. A Meta-narrative Review. October 2014. Jama Pediatr. 2014; 168(10): 901-908.
- Pillow J.J, Pillow J., Minocchieri S., Innovation in Surfactant Therapy II: Surfactant Administartion by Aerosolization. Neonatology 2012; 101:337-344.
- Christian A. Devaux, Jean-Marc Rolain, Philippe Colson, Didier Raoult (2020), New insight on the antiviral effects of chloroquine against Coronavirus: what to expect for COVID-19. International Journal of Antimicrobial Agents.
- Gautret et al. (2020), Hydroxychloroquine and azithromycin as a treatment of COVID‐19: results of an open‐label non‐randomized clinical trial. International Journal of Antimicrobial Agents – In Press 17 March 2020.